Sumber 1
UNSUR
Unsur adalah zat tunggal yang sudah tidak dapat diuraikan lagi menjadi zat yang lebih sederhana dengan reaksi kimia biasa.

Berdasarkan sifatnya, unsur dikelompokkan menjadi 3, yaitu:
- Unsur Logam
Ciri-ciri:
- warna mengkilap
- pada suhu kamar umumnya berwujud padat dan keras (kecuali raksa)
- dapat ditempa
- konduktor yang baik
- titik didih dan titik leleh pada umumnya tinggi
Contoh: litium, Ferrum (besi), Natrium, Magnesium, Kalium, Calsium, Titanium, Kromium, Mangan, Kobalt, Nikel, Tembaga, Seng, Perak, barium, Platinum, Emas, Raksa, Timbal, dll
- warna mengkilap
- pada suhu kamar umumnya berwujud padat dan keras (kecuali raksa)
- dapat ditempa
- konduktor yang baik
- titik didih dan titik leleh pada umumnya tinggi
Contoh: litium, Ferrum (besi), Natrium, Magnesium, Kalium, Calsium, Titanium, Kromium, Mangan, Kobalt, Nikel, Tembaga, Seng, Perak, barium, Platinum, Emas, Raksa, Timbal, dll
- Unsur Semilogam/Metaloid
Ciri-ciri:
- lebih lunak dari logam tetapi lebih keras dari nonlogam
- dapat menghantar panas/listrik tetapi kurang baik
Contoh: Boron, Silikon, Antimon, Germanium, Arsen, Polonium, dan Telurium
- lebih lunak dari logam tetapi lebih keras dari nonlogam
- dapat menghantar panas/listrik tetapi kurang baik
Contoh: Boron, Silikon, Antimon, Germanium, Arsen, Polonium, dan Telurium
- Unsur Nonlogam
Ciri-ciri:
- warna tidak mengkilap (kecuali intan)
- pada suhu kamar pada umumnya berwujud cair, padat, dan gas
- bersifat isolator
- lunak dan rapuh
- titik didih biasanya rendah
Contoh: Hidrogen, Carbon, Nitrogen, Oksigen, Fluorin, Neon, Phospor, Belerang, Klorin, Argon, Selenium, Bromin, Kripton, Iodin, Xenon, dan Radon
Hingga saat ini ada 118 unsur (93 unsur alami dan 25 unsur buatan). Untuk mempermudah mempelajari unsur-unsur tersebut, maka dibuatkah lambang unsur oleh John Jacob Berzelius (1779-1848). Lambang unsur diambil dari huruf awal dari nama latin unsur tersebut.
Jika ada dua unsur atau lebih yang memiliki huruf awal sama, maka unsur-unsur tersebut dilambangkan dengan dua huruf (huruf awal diikuti salah satu huruf berikutnya). Untuk penulisan lambang unsur, huruf pertama selalu ditulis dengan huruf kapital.
Contoh:
Boron (B)
Bromin (Br)
Carbon (C)
Calsium (Ca)
Clorin (Cl)
Cobalt (Co)
Hidrogen (H)
Helium (He)
Litium (Li)
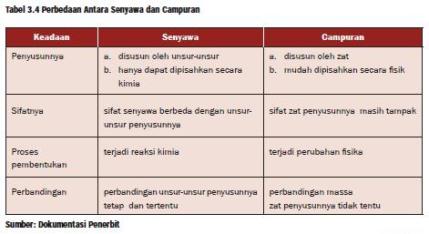
SENYAWA
Senyawa adalah zat tunggal yang dapat diuraikan kembali menjadi zat yang lebih sederhana melalui reaksi kimia.
Ciri-ciri senyawa:
- warna tidak mengkilap (kecuali intan)
- pada suhu kamar pada umumnya berwujud cair, padat, dan gas
- bersifat isolator
- lunak dan rapuh
- titik didih biasanya rendah
Contoh: Hidrogen, Carbon, Nitrogen, Oksigen, Fluorin, Neon, Phospor, Belerang, Klorin, Argon, Selenium, Bromin, Kripton, Iodin, Xenon, dan Radon
Hingga saat ini ada 118 unsur (93 unsur alami dan 25 unsur buatan). Untuk mempermudah mempelajari unsur-unsur tersebut, maka dibuatkah lambang unsur oleh John Jacob Berzelius (1779-1848). Lambang unsur diambil dari huruf awal dari nama latin unsur tersebut.
Jika ada dua unsur atau lebih yang memiliki huruf awal sama, maka unsur-unsur tersebut dilambangkan dengan dua huruf (huruf awal diikuti salah satu huruf berikutnya). Untuk penulisan lambang unsur, huruf pertama selalu ditulis dengan huruf kapital.
Contoh:
Boron (B)
Bromin (Br)
Carbon (C)
Calsium (Ca)
Clorin (Cl)
Cobalt (Co)
Hidrogen (H)
Helium (He)
Litium (Li)
SENYAWA
Senyawa adalah zat tunggal yang dapat diuraikan kembali menjadi zat yang lebih sederhana melalui reaksi kimia.
Ciri-ciri senyawa:
- merupakan zat tunggal
- tersusun dari dua unsur atau lebih dengan perbandingan tertentu dan tetap
- dapat diuraikan menjadi unsur-unsur pembentuknya melalui reaksi kimia
- sifat senyawa berbeda dengan sifat unsur pembentuknya
Contoh senyawa: Air (H2O), Garam dapur (NaCl), Asam Clorida (HCl), Karbondioksida (CO2), Karbon monoksida (CO).
Penamaan Senyawa:
Penamaan Senyawa:
- Senyawa yang Terbentuk dari Unsur Logam dan Nonlogam
Cara penamaan: Sebut dahulu nama unsur logam kemudian diikuti nama unsur non logam dan diberi akhiran -ida
Contoh:
NaCl tersusun atas unsur logam Natrium (Na) dan unsur nonlogam Clorin (Cl), sehingga diberi nama Natrium clorida
Contoh:
NaCl tersusun atas unsur logam Natrium (Na) dan unsur nonlogam Clorin (Cl), sehingga diberi nama Natrium clorida
- Senyawa yang Terbentuk dari Unsur Nonlogam-Nonlogam
Cara penamaan: Jumlah unsur atom pertama disebut dahulu, diikuti nama
unsur nonlogam pertama, kemudian sebut jumlah unsur nonlogam kedua dan
diikuti nama unsur nonlogam kedua, dan diberi akhiran -ida
Jumlah atom disebut dalam bahasa Yunani sebagai berikut:
1 = mono
2 =di
3 = tri
4 = tetra
5 = penta
6 = heksa
7 = hepta
8 = okta
9 = nona
10= deka
Contoh:
N2O diberi nama dinitrogen monoksida
NO diberi nama nitrogen monoksida
N2O5 diberi nama dinitrogen pentaoksida
P2O5 diberi nama diphospor pentaoksida
CCl4 diberi nama carbon tetraklorida
Jumlah atom disebut dalam bahasa Yunani sebagai berikut:
1 = mono
2 =di
3 = tri
4 = tetra
5 = penta
6 = heksa
7 = hepta
8 = okta
9 = nona
10= deka
Contoh:
N2O diberi nama dinitrogen monoksida
NO diberi nama nitrogen monoksida
N2O5 diberi nama dinitrogen pentaoksida
P2O5 diberi nama diphospor pentaoksida
CCl4 diberi nama carbon tetraklorida
CAMPURAN
Campuran adalah kumpulan dari beberapa zat dengan komposisi bebas.
Campuran dikelompokkan menjadi dua:
Campuran adalah kumpulan dari beberapa zat dengan komposisi bebas.
Campuran dikelompokkan menjadi dua:
- Campuran Homogen: campuran yang komposisi tiap bagiannya merata
- contoh:
- - campuran air dengan sirup,
- - campuran air dengan susu,
- Campuran Heterogen: campuran yang komposisi tiap bagiannya tidak merata.
Contoh :
- campuran air dengan kopi
- campuran air dengan lumpur
- campuran dalam es buah
Pemisahan Campuran
Penyaringan/Filtrasi
Penyaringan adalah pemisahan campuran yang didasarkan pada perbedaan ukuran partikel.
Contoh:
- Pemisahan campuran antara air dengan pasir
- Pemisahan campuran antaraZat hasil penyaringan disebut filtrat, dan zat sisa dari penyaringan disebut residu.
Penyulingan/Distilasi
Penyulingan adalah pemisahan campuran berdasarkan perbedaan titik didih.
Contoh:
- Pemisahan campuran antara air dengan alkohol
- Pemisahan air dengan minyak tanah
Kromatografi
Kromatografi adalah pemisahan campuran yang di dasarkan pada perbedaan daya serap suatu zat terhadap bahan penyerap. Kromatografi digunakan untuk memisahkan campuran warna pada tinta.Kristalisasi
Kristalisasi adalah pemisahan campuran untuk memisahkan zat terlarut dari larutannya.
Proses kristalisasi dimanfaatkan untuk:
- membuat garam dari air laut
- membuat gula pasir dari air gulaSentrifugasi
Pemisahan ini dilakukan dengan memasukkan suspensi ke dalam tabung reaksi, kemudian dipusingkan/diputar dengan kecepatan tertentu. Pemusingan yang sangat cepat menyebabkan partikel tersuspensi mengendap di dasar tabung reaksi. Selanjutnya cairan dapat dituang secara hati-hati sehingga dapat terpisah dengan zat padat yang mengendap.
Sentrifugasi dapat digunakan untuk memisahkan plasma darah dari darah merah.Ekstraksi
Ekstraksi adalah pemisahan campuran dengan menggunakan dua pelarut yang tidak saling bercampur. Pemisahan ini dapat dilakukan dengan corong terpisah sehingga dapat memisahkan zat yang larut dalam minyak dan zat yang larut dalam air. Zat yang larut dalam air biasanya ada di bagian bawah, sehingga ketika kita membuka keran pada corong pisah, air dan zat yang terlarut akan keluar dan minyak serta zat yang terlarut di dalamnya akan tertinggal. Selanjutnya untuk pemurnian zat dapat dilakukan dengan distilasi.Sublimasi
Pemisahan campuran dengan sublimasi dilakukan jika ada zat padat yang menyublim bercampur dengan zat yang tidak dapat menyublim. Contoh zat yang mudah menyublim adalah kapur barus, iodin, dan kafein.
Sumber 2
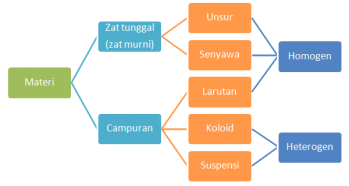
Unsur, Senyawa dan Campuran
Zat tunggal dapat berupa
unsur dan senyawa, sedangankan campuran ada yang bersifat homogen, ada
pula yang heterogen. Dengan demikian, klasifikasi materi adalah seperti
pada gambar 1 dibawah ini:
I. Unsur
Unsur adalah zat tunggal yang tidak dapat diuraikan.
Perluh dipahami bahwa menguraikan tidaklah sama dengan memotong-motong
atau menghaluskan. Penguraian menghasilkan dua jenis atau lebih zat baru
yang berbeda dari zat semula, sedangkan memotong-motong atau
menghaluskan hanya mengubah bentuk, tetapi tidak mengubah jenis zatnya.
Untuk meringkaskan dan memudahkan penulisan,maka setiap unsur diberi
suatu lambang yang kita sebut lambang unsur atau lambang atom.
Contoh:
Karbon (C)
Kalsium (Ca)
Perhatikan beberapa contoh pada tabel 1 berikut ini.
Tabel 1. beberapa contoh unsur
|
Nama unsur(Indonesia)
|
Nama lain
|
Lambang
|
|
Karbon
Kalsium
Klorin
Tembaga
Kalsium
Perak
|
Carbonium
Calsium
Clorin
Cuprum
Calsium
Argentum
|
C
Ca
Cl
Cu
K
Ag
|
II. SENYAWA
Senyawa adalah zat tunggal yang dapat diuraikan menjadi dua jenis
atau lebih sederhana. Penguraian senyawa dapat terjadi karena pemanasan
atau aliran listrik.
Contoh senyawa: Air, gula, garam, dan asam cuka.
a. Molekul
Bagian terkecil dari senyawa adalah molekul. Molekul senyawa terbentuk dari perikatan dua jenis atau lebih atom unsur.
b. Rumus Kimia
Senyawa juga diberi lambang, lambang senyawa ini disebut rumus kimia. Rumus kimia dari beberapa senyawa diberi pada tabel berikut:
Tabel 3. Rumus kimia dari beberapa senyawa
|
Nama zat
|
Rumus kmia
|
|
Air
Amoniak
Asam cuka
Sukrosa(gula)
|
H2O
NH3
CH3COOH
C12H22O11
|
III. Campuran
Campuran adalah materi yang terdiri dari dua jenis zat atau lebih.
Sifat campuran merupakan rata-rata dari sifat komponen-komponennya.
Sifat manis dari gula tidak hilang ketika dicampur dengan air. Demikian
juga dengan sifat asin dari garam. Jika ke dalam air dilarutkan gula dan
garam, maka larutan akan mempunyai rasa manis sekaligus asin.
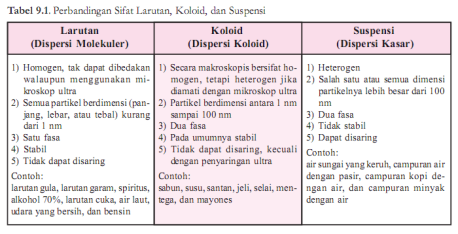
Tiga Jenis Campuran: Larutan, Koloid, dan Suspensi
1) Larutan
Larutan adalah campuran homogen. Suatu campuran dikatakan homogen
jika antara komponennya tidak terdapat bidang batas, sehingga tidak
terbedakan lagi walaupun menggunakan mikroskop ultra.
2) Suspensi
Suspensi adalah campuran kasar dan bersifat heterogen. Antara
komponennya masih terdapat bidang batas dan sering kali dapat dibedakan
tanpa menggunakan mikroskop. Istilah suspensi biasanya dimaksud untuk
campuran hererogen dari suatu zat padat dalam zat cair. Suspensi tampak
keruh dan tidak stabil
3) Koloid
Koloid adalah suatu bentuk campuran yang keadaannya terletak antara
larutan dan suspensi. Contohnya santan, air, susu, air sabun, dan cat.
Dibawah ini adalah tabel perbedaan unsur, senyawadan campuran
Sedangkan perbedaan larutan, suspensi dan koloid adalah seperti pada tabel dibawah ini:
-Semoga Bermanfaat-











Tidak ada komentar:
Posting Komentar